Dr. José Lucas do Centro de Biologia Molecular Severo Ochoa de Madrid falou sobre este trabalho recente sobre o papel do mHTT no splicing alterado e adenilação de mRNAs na DH. O José começou por descrever o seu trabalho pioneiro em alterações de splicing da tau no cérebro da DH. Ele também descreveu alterações de splicing na proteína TAF1, que leva à degeneração estriatal e discinesias em um distúrbio genético raro. Ele postula que o mHTT leva a mudanças no SRSF6 com múltiplos efeitos, um para modular o splicing de Tau e, segundo e, para uma perda de função de TAF1. Devido a essas observações independentes, seu laboratório buscou uma análise imparcial mais profunda de proteínas de ligação ao RNA e eventos globais de misplicing que ocorrem na DH. Ele identificou 342 genes incorretos em amostras humanas e de roedores, incluindo vários genes conhecidos por levar à degeneração quando mutados. Ele então se concentrou em fatores de splicing alterados que poderiam explicar os fenótipos observados, como TIA1, hNRPC, U2AF2 e RBFOX, sendo este último um fator chave que é regulado negativamente na DH. Eles criaram um camundongo transgênico superexpressando RBFOX1 e os cruzaram com o modelo de camundongo R6/1, levando a uma atenuação da doença. Ele se referiu ao trabalho feito em 2011 pela Dra. Nancy Bonini e focou em um conjunto de genes conhecidos por moderar a toxicidade do RNA em moscas, incluindo o musclebound e o orb2 (CPEB4 é o ortólogo dos mamíferos), um gene que regula a poliadenilação. O CPEB também fornece regulação da tradução nas sinapses de maneira temporal. Jose então mostrou que CPEB1 e -4 estão alterados na DH, e determinou que 20% dos transcritos apresentam alterações na adenilação, incluindo SLC19A3, um transportador de tiamina no endotélio cerebral. Deficiências em SLC19A3 podem ser restauradas pela administração de biotina, presumivelmente por meio de um efeito nos níveis de SLC19A3. Portanto, se sua hipótese estiver correta, então os pacientes em HD deveriam ter menos concentração de tiamina no LCR e no parênquima cerebral. Um conjunto final de estudos mostrou que a terapia de suplementação de tiamina e biotina pode restaurar mudanças comportamentais em modelos R6/2 e Q175. Uma patente foi registrada e um pequeno estudo clínico foi planejado (chamado estudo HUNTIAM) para avaliar a segurança dessa estratégia de suplementação e as doses que funcionam em camundongos são muito altas e mostraram alguma toxicidade nos estudos com roedores. Trabalho adicional para estender os níveis diminuídos de tiamina no LCR está sendo explorado em um estudo longitudinal com o hospital Sant Pau em Barcelona.
Dr. MICHAEL RAPE
Dr. Michael Rape da Berkeley University e do Howard Hughes Medical Institute falou sobre os mecanismos que degradam a proteína HTT via proteassoma, uma etapa crítica na regulação do nível de expressão da proteína e uma área importante para o desenvolvimento terapêutico. Os principais desafios para esta área têm sido a identificação de complexos ubiquitina-ligase que podem modificar o HTT e direcioná-lo para degradação, e os resíduos de aminoácidos lisina específicos que são modificados e regulam sua meia-vida. Ele então descreve o recente trabalho não publicado que o levou a identificar a ligase E3 que trabalha para modificar o HTT diretamente e degradá-lo. Sua equipe reconstituiu a ubiquitinação do HTT in vitro, abrindo caminho para a identificação de sítios modificados do HTT e de um sistema de triagem para identificar colas moleculares – pequenas moléculas que promovem a interação entre o HTT e a E3 ligase identificada.

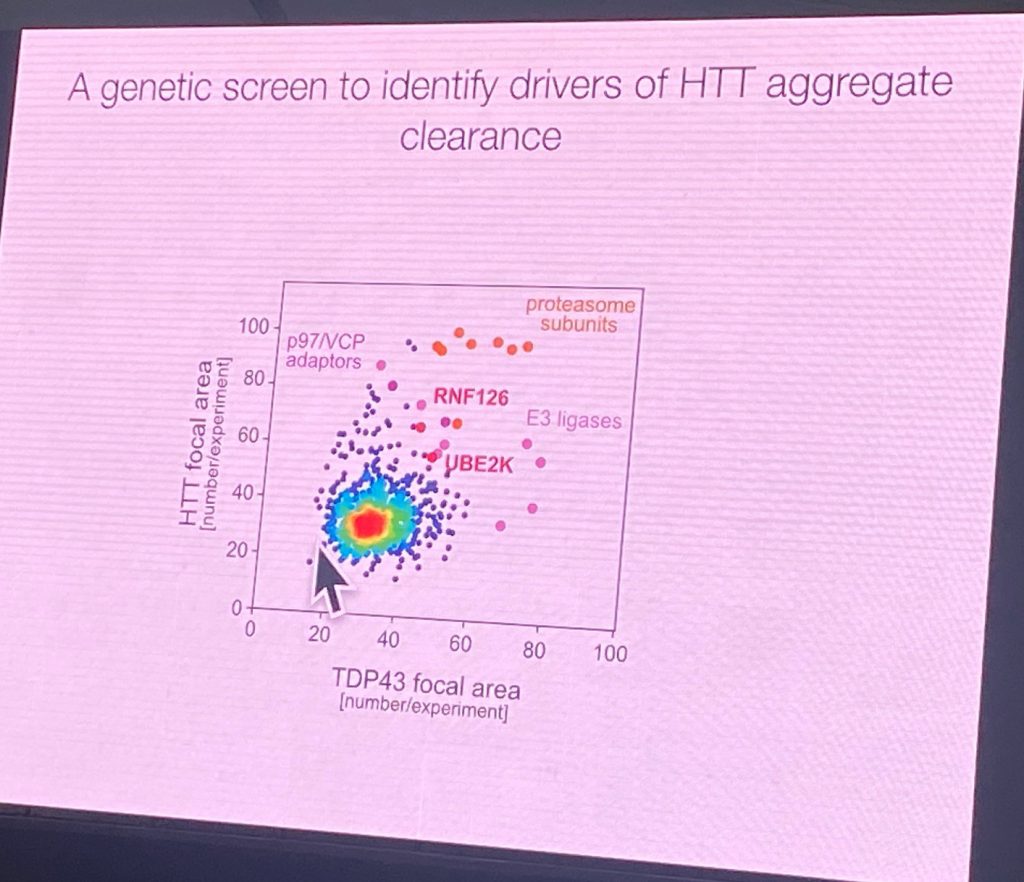
Ele afirma que os sinais de degradação para HTT estão na região após o primeiro domínio HEAT de HTT. Usando uma fusão GFP com 508 AA N-terminal HTT e realizando uma triagem em células de neuroblastoma transfectadas de forma estável para identificar fatores que promoveriam a agregação desse fragmento (que normalmente não agrega). Usando vários sinais de estresse, os agregados aparecem nessas células e, após a remoção dos estressores, os agregados ('focos') são eliminados. A exposição prolongada ao estresse leva a uma agregação dependente do comprimento do CAG, mesmo após longos períodos de washout. Isso permitiu uma triagem genômica de E3 ligase e efetores que levou à identificação dos complexos que podem afetar esse processo, retardando a eliminação de HTT, RNF126b e UBE2K. RNF126 se liga diretamente ao HTT e à desagregase p97/VCP. Também é altamente expresso no cérebro. Além disso, o laboratório de Rape mostrou que um ensaio de degradação pode ser desenvolvido para mostrar a atividade direta dos complexos RNF126 no HTT nas células. RNF126 KO aumentou a agregação de HTT, e a superexpressão pode degradá-la em um contexto celular. Além disso, um sistema de ubiquitinação reconstituído foi obtido com RNF126 e HTT purificados. Os mutantes pontuais que inativaram a atividade catalítica do RNF12 não apresentaram tal atividade. As enzimas E2 são UBE2K e UBE2D3. Ele também mostrou que este sistema também funciona para ubiquitinação HTT de comprimento total, não apenas no sistema de repórter mais curto.
Seu trabalho sugere que existe um sistema para controlar a agregação de HTT e, portanto, abrir caminho para a identificação de pequenas moléculas que podem direcionar o HTT para degradação.