Sandrine Humbert de INSERM, Grenoble Instituto de Neurociencias, habló sobre el papel de tipo salvaje HTT en el desarrollo del cerebro. Sandrine postulados de que un componente importante de la patogénesis de alta definición implica la pérdida de la función normal de la HTT función(s), que implican, entre otras funciones, la asamblea de los complejos moleculares, incluyendo a los transportados por los microtúbulos, y en el contexto de la ciliogenesis. Ella también se especula con la posibilidad de que una primaria suceso patológico es la pérdida de la cortical aferentes de apoyo para el cuerpo estriado espinosas de la producción de neuronas, en parte, por una pérdida de soporte neurotrófico impulsado por el BDNF/TrkB de señalización. Sandrine revisado el trabajo previo apoyar estas hipótesis, que de dar credibilidad a la idea de que el desarrollo de las funciones de la HTT son impactados en HD. Un efecto importante de la pérdida de la normal HTT durante el desarrollo de alteraciones en la progresión del ciclo celular durante la neurogénesis (menos neuronas que están siendo generados) y los cambios en la polaridad neuronal, que se reflejan en muchos contextos diferentes durante el desarrollo de las neuronas corticales, incluyendo en la morfología dendrítica en las neuronas postmitóticas.
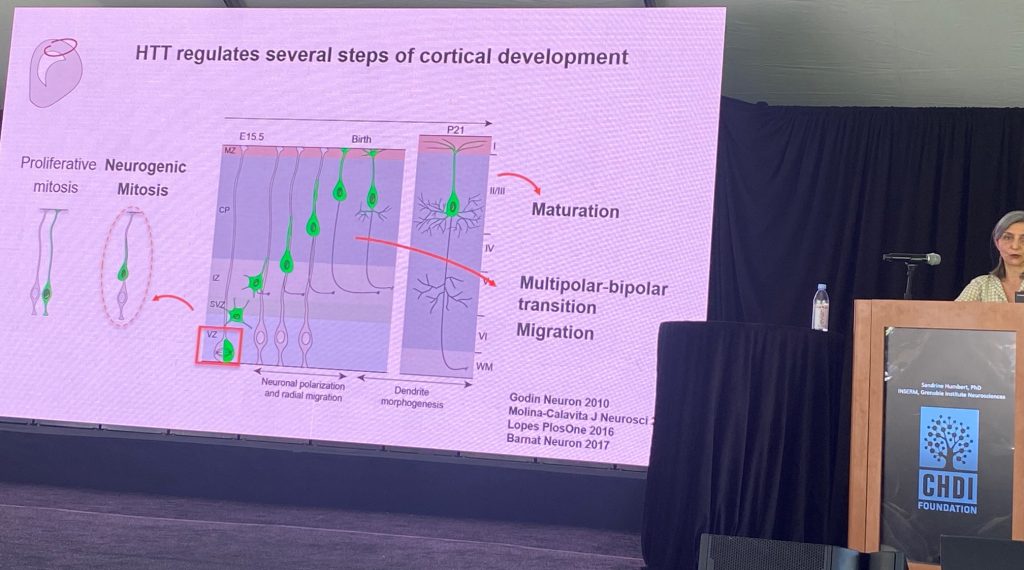
Algunos de los déficits observados en roedores HTT nocauts parecen ser encontrados en el análisis histológico realizado en tejidos fetales humanos, aunque el tamaño de la muestra es pequeño. Parece ser que la convergencia de evidencia de un cambio en la localización de HTT en HD y un cambio en la polaridad celular en el desarrollo temprano de la corteza, así como en el déficit en el número y la morfología de los cilios en la cortical de células progenitoras. Aparentemente observación compartida entre los modelos de roedores y HD individuos incluyen agenesia parcial del cuerpo calloso (que es, que algunos de los más famosos de la pérdida de las fibras del cuerpo calloso en HD, debido a un problema de crecimiento axonal durante el desarrollo). Sandrine, a continuación se describe la función de la proteína NUMA1 en el cono de crecimiento axonal de los déficits en las neuronas derivadas de knock-en modelos de ratón. La expresión de más de NUMA1 en Q111 ratones puede restaurar el cuerpo calloso déficits de desarrollo en este modelo. También demostraron que epothiloneB, un producto natural que interfiere con la polimerización de la tubulina y también conduce a mejoras en la estructura del cuerpo calloso en este modelo.
RAFAELLE LENNACO
Rafaelle Iennaco (postdoc del Dr. Elena Cattaneo del grupo), de la Universidad de Milano habló sobre el rol de los residuos específicos en el exón 1 del gen HTT en la modulación de su función. Rafaelle ha diseñado ratón células madre que expresan diferentes deleciones y mutaciones puntuales en el gen HTT, y su relación con su función de desarrollo. En la evolución, el número de repeticiones de CAG comienza a aumentar a partir de aves, reptiles, peces y anfibios (4Qs), mientras que en los mamíferos, el rango es entre 5-35 repeticiones de CAG. El N17 es muy conservado, pero el poli-prolina de dominio (el "PRD") es muy divergentes también a través de la evolución, que aparece sólo en los mamíferos. Sin embargo, el papel de estas 3 regiones y la importancia de los residuos específicos no se ha diapositivas en la profundidad suficiente. Por lo tanto, diseñaron un gran conjunto de mES, las células que expresan diversos longitud de la polyCAG tracto (Q= 0, 2, 4, 7 ,17 etc.) y demostrado que el impacto de un desarrollo temprano de defectos observados en la cultura. también se han identificado un conjunto de genes cuya expresión se correlaciona con el número de CAGs en el rango normal, revelando los genes implicados en el desarrollo del sistema nervioso.
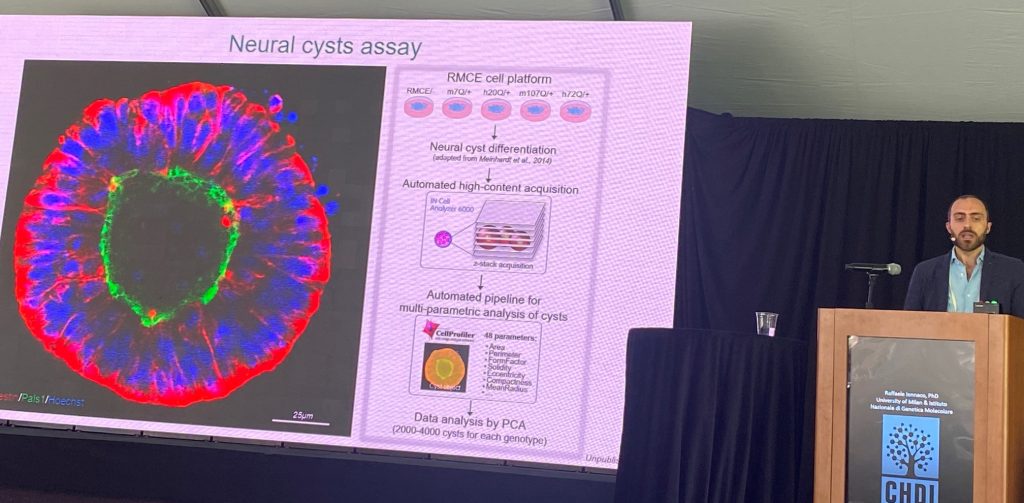
La etapa siguiente de la presentación se centró en la comprensión del papel patogénico de los humanos HTT mutante (más patógena que el ratón exón 1). En comparación con el mismo patógeno rangos de repeticiones de CAG en el contexto humano versus el ratón contexto, en el contexto de la morfología de las neuronas 'quistes" y en la morfología, en la cultura, el apoyo a que las secuencias humanas de la materia en el desencadenamiento de estos déficits. Desde los principales cambios entre el exón-1 de ratón vs humanos HTT reside en la poliprolina región, un conjunto de knock-en las células madre se genera en el polipropileno regiones donde la conmutación entre el ser humano y el ratón. los humanos poliprolina región es importante para la patogénesis de estos dos sistemas. Humanos de la región empeora, y el ratón de la región de mejora, la describe fenotipos.
EL DR. BALJIT DE COLOR CAQUI
El Dr. Baljit de color Caqui de la UCLA describió su trabajo en la patogenicidad de impacto de mHTT en R6/2 y Q175 modelos de ratón, en términos de las células específicas de los déficits, comparando el papel patogénico de mHTT en los astrocitos vs neuronas en el cuerpo estriado (en un fisiológicas, moleculares y de nivel conductual). Mal es un líder mundial de los astrocitos de la fisiología y su papel en las funciones normales del cerebro y en la enfermedad. En este seminario, Bal mostró que muchos de estos déficits pueden ser prevenidos/restaurado después de que las células del cuerpo estriado están expuestos a un mHTT específicas de los dedos de zinc de la proteína represora (ZFP) que inhibe la expresión de mHTT específicamente sin afectar el normal HTT expresión. La novedad de su trabajo más reciente es el hecho de que su equipo se expresó la mHTT ZFP sólo en las neuronas o sólo en los astrocitos, y es capaz de analizar el impacto de la supresión de mHTT en términos de la célula autónoma vs no autónomas mecanismos celulares – por lo tanto, señalando el tipo de célula más importante en la conducción de los mecanismos patogénicos. Es decir, inferior mHTT en los astrocitos y estudio de los efectos sobre los astrocitos y las neuronas (que expresan mHTT todavía), y viceversa. Sus resultados confirman que, en el ratón de modelos de alta definición, la expresión neuronal de mHTT es el evento más importante en la conducción de la progresión de la enfermedad, y que la mayoría de los astrocitos son los cambios de adaptación a los déficits activa en las neuronas del cuerpo estriado por mHTT.

Bal también describe el hecho de que los astrocitos GPCRs que la señal a través de Gi acoplamiento puede restaurar parcialmente los síntomas de la enfermedad en varios modelos de alta definición, lo que demuestra que esto es potencialmente valiosa estrategia terapéutica. Él amplió estos esfuerzos anteriores, publicada en el año 2021, para estudiar el papel de mHTT los efectos de la supresión de las neuronas vs los astrocitos a entender los mecanismos por los cuales mHTT contribuye a la enfermedad y los tipos de células más importante para la enfermedad. El ZFPs se expresaron en virus AAV y se utiliza ampliamente en vivo en las distintas etapas de desarrollo de la enfermedad. Un mensaje clave es que los cambios en los astrocitos se relacionan con el metabolismo del colesterol se confirmó, y que esta vía puede ser rescatado por células de forma autónoma cuando mHTT se suprime en los astrocitos. Bal de laboratorio también utiliza técnicas electrofisiológicas para mostrar la restauración de anormal de la cocción y propiedades de las células después de la neuronales, pero no de los astrocitos, mHTT bajar.

Una última serie de experimentos fue inferior mHTT todo el cerebro por el uso de AAV PHPeb para conducir la expresión de la ZFP. Este tratamiento ha demostrado mejorar la enfermedad de medidas en R6.2 ratones, una muy agresivo modelo de HD. Estos estudios también demostraron que la expresión neuronal de la ZFP, pero no de los astrocitos. expresión rescata de los déficits de comportamiento por varios extremos (anidación, campo abierto, juntando, etc.).




